2020.12.27
PirikaでSTEAM>デジタル分子模型で見る化学結合> 6. フロンティア分子軌道から、作られる直前の化学結合の様子を見る事ができる。
試しにこれらのページで電子書籍を作ってみました。
epub3のビュアーを持っているなら試してみるのも良いでしょう。
エチレンの分子軌道を計算すると次のようになります。
最初に表示されている分子軌道はHOMOの分子軌道です。
HOMOというのは、Highest Occupied Molecular Orbitalで最高被占軌道、つまり電子が入っている軌道のうち一番エネルギーレベルが高い軌道のことです。
Upperボタンを押すと、LUMOの分子軌道が表示されます。
LUMOというのはLowest Unoccupied Molecular Orbitalで最低空軌道、つまりエネルギーの一番低い、電子の入っていない分子軌道のことです。
LUMOのエネルギー準位は4.92eVです。
そして特徴的なのが、赤丸と青丸が入れ替わっている事です。この状態を、節があると言います。位相が揃っていないので、反結合性の軌道になっていると言う言い方をします。
この、HOMOとLUMOの軌道は、(HOMOから)電子を他の分子に渡す場合にも、他の分子から(LIMOに)電子を受け取る場合にも大事な分子軌道になります。
電子が詰まっているハズレの軌道(HOMO)と電子が詰まっていないハズレの軌道(LUMO)と言う事で、フロンティア(辺境の)分子軌道という言い方をします。
これは、1952年に福井謙一先生によって提唱され、1981年にノーベル化学賞に輝いた理論です。
例えば、ブタジエンのような共役ジエンとエチレンのようなアルケンが付加反応を起こして6員環構造を作る、Diels-Alder(ディールス・アルダー)反応という反応があります。これは1950年にノーベル化学賞を得た反応です。

この反応をCNDO/2の計算結果から見てみましょう。
次の図がブタジエンのCNDO/2の計算結果です。
ブタジエンのHOMOとエチレンのLUMO,
もしくは
ブタジエンのLUMOとエチレンのHOMO
位相が重なるかを見てください。
前章で説明したように、青と青、赤と赤の球が揃って重なるときに結合ができます。
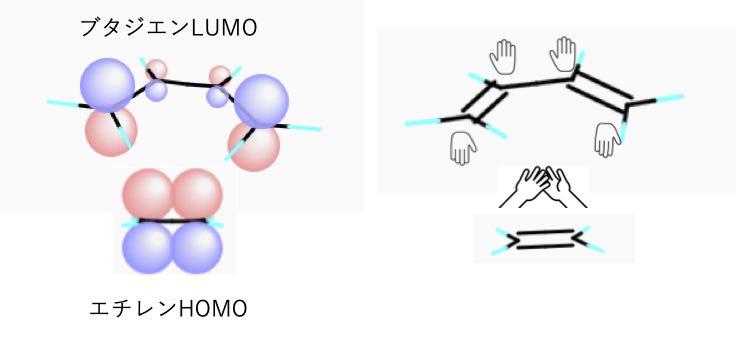
エチレンはハイタッチでπ結合しているよりも、ブタジエンと握手するσ結合を選ぶという事です。
この反応が、フロンティア電子理論やウッドワード・ホフマン則(1965年発表、福井先生と1981年ノーベル化学賞)で説明できる事がCNDO/2の計算結果からもわかるでしょう。
逆に手を離したがっている結合についても見えてきます。
ジメチル・パーオキサイドの分子軌道を計算すると次のようになります。
最初に表示しているのは、HOMOの分子軌道ですが、二つの酸素上には位相の異なった軌道がある事がわかります。つまりこの結合は反結合性の軌道になります。
そこでShow Chargeにチェックを入れると、分子軌道図から電荷表示に切り替わります。
電荷で見ても酸素同士は負電荷を帯びています。
そこで、この結合は温度によって容易に開裂してラジカルを発生する事がわかります。
ラジカルというのは、握っていた手を離して、分子軌道に1つだけ電子がいる状態です。SOMO(Single Occupied Molecular Orbital)という言い方をします。
このラジカルは、反応性が高くて、2重結合のハイタッチしているHOMOにアタックし、π結合の手を引き剥がし、σ結合を作ります。2重結合に残されたもう一つの手は、ラジカルになって他の2重結合に反応します。
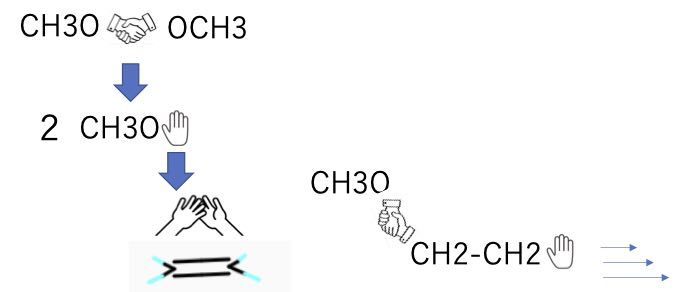
繰り返すと大きな分子=ポリマーになるので、こうしたパーオキサイドはラジカル重合の開始剤と呼ばれています。
1.分子構造の調整。
2.分子集合体の分子模型作成。 ちょっと計算が重いので注意
3.各原子上の電荷を計算。 ちょっと計算が重いので注意
4.ある温度における分子(原子)の運動。
5.π結合とσ結合の違い。
6.作られる直前の化学結合の様子。
7.HOMO-LUMO遷移エネルギーと化学結合。
8.振動解析結果のアニメーション。
9.デジタル教科書の作成。
試しにこれらのページで電子書籍を作ってみました。
epub3のビュアーを持っているなら試してみるのも良いでしょう。
10.豊かな化学のために。
12.全フッ素化キュバンのLUMOが電子を閉じ込めた!
Webアプリ版、CNDO/2を使った教材作成について
「こういう教材を作りたいので、pirikaのアプリを使いたい」と言うご要望がありましたら、メールを頂ければ幸いです。
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください。
