2020.12.27
PirikaでSTEAM>デジタル分子模型で見る化学結合> 5. π結合とσ結合の違いを分子軌道から理解する事ができる。
試しにこれらのページで電子書籍を作ってみました。
epub3のビュアーを持っているなら試してみるのも良いでしょう。
https://youtu.be/w01AjEebRTI
こうしたインターラクティブなページをパワポ資料に持ち込むには?
動画で紹介しました。
第1章で、単結合を回転した場合に配座異性体ができることを説明しました。
それでは、単結合と多重結合の違いを見ていきましょう。
実際の分子模型では次のような湾曲した棒を使って、2重結合を作る事が多いです。

これは、炭素-炭素の結合長が多重度が上がるにつれて短くなるので、ある意味正しいです。
C-C 1.54Å
C=C 1.47Å
C≡C 1.37Å
そして、湾曲した2-3本の化学結合があるので、多重結合の間では回転は起きないという説明は納得しやすいでしょう。
しかし、そう考えてしまうと、2本(3本)の結合は等価なものになってしまいます。現実にはこの結合は等価では無いので、合理的な説明が必要になります。
難しい言い方(説明しにくい言い方?)になりますが、原子核の周りには電子が回っています。太陽の周りを惑星が回っている事をイメージしてください。全部の電子が同心円を描いて回っているのではなく、ハレー彗星のように偏った動き方をするものもあるので、軌道という言い方をします。(阪神の優勝はハレー彗星が帰ってくるまで無いと言われていたのに意外と早く帰ってきました)
原子と原子が集まって分子を作るときには、電子は分子の周りを回るので、分子軌道という言い方をします。
そして、原子核のそばを回る軌道から順番に2つずつ電子が入っていきます(パウリの排他律と言います)。そして原子核から離れるにつれて、不安定になっていきます。
化学結合というのは、各原子から電子を1つ出しあって(電子2つで)握手しているようなものと考える事ができます。強く握り合っているので、エネルギー的に安定した結合です。
さて、ここでエタン(CH3CH3)を考えてみましょう。炭素は4つの電子、水素は1つの電子を持ちます。(正確には炭素は6つの電子を持ちますが、内殻の電子2つは結合に関与しないので便宜的には4つと数えます。)
電子1つが手1つだとすると次のような模式図になります。
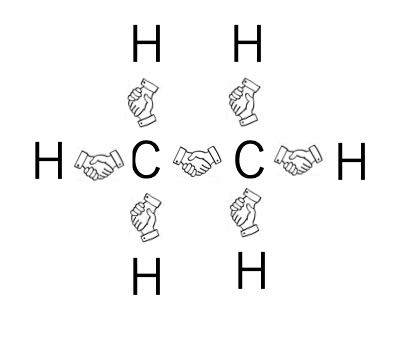
全ての電子が握手できている事が分かるでしょう。
それでは、エチレン(CH2=CH2)ではどうでしょうか?
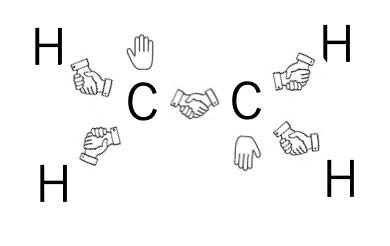
炭素は1つずつ電子が余ってしまいます。
炭素炭素の間の分子軌道は既に他の電子が収まってしまっています。(同じ軌道には電子は2つまでしか入れません。)
そこで、エネルギーの高い分子軌道を取らなくてはならなくなります。
この問題に先人たちは、2重結合は1本のσ(シグマ)結合と1本のπ(パイ)結合からできていると考えました。3重結合は1本のσ結合と2本のπ結合からできていると考えるのです。
この、σ結合は炭素と炭素が握手しているような強い結合です。π結合は炭素と炭素がハイタッチしているようなもので、あまり強い結合ではありません。 そこで他のもの(例えば水素)と反応したりする事ができます。
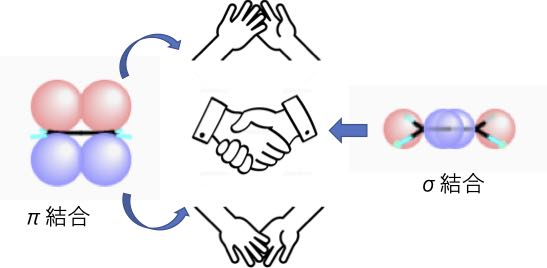
これらの化学結合を見るためには、デジタル分子模型を利用せざるを得ません。つまり、分子軌道をみる必要があります。
分子軌道を計算するソフトは、様々な物があります。フリーのものも多いので、そうしたものを使うのも良いでしょう。
ここでは、半経験的分子軌道法CNDO/2で計算したエチレンの分子軌道を見てみましょう。ここで使っているソフトはブラウザーの上でCNDO/2の計算をするソフトです。実際に分子を動かして分子軌道を見てください。
CNDO/2の説明はこちらのページを参照してください。
分子を回転:マウスでドラッグ(マウスボタンを押したまま動かす) iPadでは指一つで押さえて動かす
位置を動かす:Alt(MacではOption)キーを押しながらドラッグ。 iPadでは指3本で動かす
拡大・縮小:Shiftキーを押しながらドラッグ。iPadでは指二本で横に広げる、狭める。
エチレンの2つの炭素と4つの水素は一つの平面に乗ります。
そして、平面の上下に青い球と赤い球が乗っているのが分かると思います。
青色は青色同士ハイタッチして、赤色は赤色同士ハイタッチしている結合をπ結合と呼びます。
本来は、この分子軌道は等高線で表すものです。
しかし、非力なマシンでも表示できるように単純な球で表してあります。
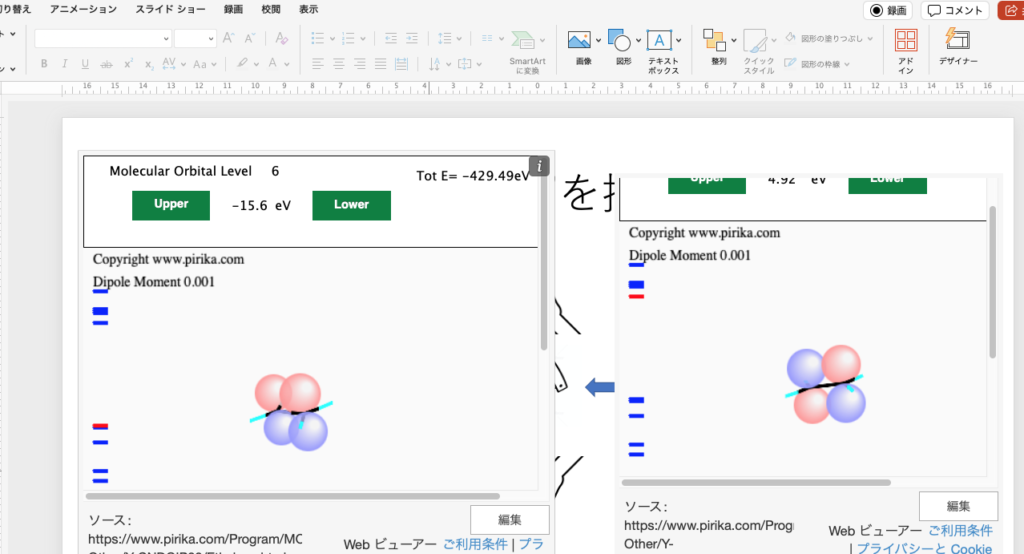
左の端にバーコードのようなものがあります。これは分子軌道のエネルギー準位を表します。
現在の赤い線は電子が2個ずつ詰まった分子軌道のうち一番エネルギーの高い順位-15.6eVであることを示しています。
一つ下の軌道(Lowerボタンを押す)を見ると、-15.8eVは(黄色は見えにくいですが)水素と炭素のσ結合があります。水素の位置にある球はs軌道を表し、黄色は炭素の青い方、水素の緑は炭素の赤い方とσ結合を作っています。
さらに1つ下の軌道をみると、炭素-炭素のσ結合を見る事ができます。
これは、側面で重なっているπ結合と異なり、炭素炭素の間で重なるので、非常に強い結合になります。
また、σ結合だけであれば回転しても、それほど大きな影響はない事が分かるでしょう。(重なり方が変わるわけではありません。)
それでは、2重結合を強引に回してみましょう。
デジタル分子模型の良いところで、90°回転させた構造をすぐに作る事ができます。
このような構造を取ると一番高い分子軌道のエネルギー準位は-15.6eVから-10.27eVへ高くなり、全エネルギー(Tot E)も-429.49eVから-420.46eVとなります。
そのようなエネルギーを分子に与えないと2重結合は回転できないし、でもそのようなエネルギーを与えたら、炭素と水素の結合が切れて壊れてしまうので、2重結合は回転しません。
アセチレン(HC≡CH)は直線分子なので軸方向の回転は立体障害がなく回転しやすそうですが、炭素炭素の間では回転しません。
その理由はもうお分かりでしょう。
同じ軌道エネルギー -17.52eVに90°ずれたπ結合が2つあるからです。
同じ分子軌道には電子は2個までしか入れませんが、直交している軌道は混じる事が無いので、同じエネルギーを取る事ができます。
それでは、炭素ではなく窒素や酸素の場合はどうなるでしょうか?
窒素は電子を5個、酸素は6個持ちます。
一番単純な窒素化合物、アンモニア(NH3)は8個の電子を持ちます。
一番単純な酸素化合物、水(H2O)も8個の電子を持ちます。
比較のため言うのなら、一番単純な炭素化合物、メタン(CH4)も8個の電子を持ちます。
電子は軌道エネルギーの低い方から2つずつ入っていきます。
すると、アンモニア、水、メタンはどれも8つの電子なので、4つの分子軌道を持ちます。
しかし、窒素の5個の電子のうち3つは手を結べますが、残りの2つは手を結ぶ相手がいません。
酸素の6つの電子のうち2つは手を結べますが、残りの4つは手を結ぶ相手がいません。
そこで、仕方がないので、相手なしで自分で手を合わせてしまします。
模式図で表すと次のようになります。
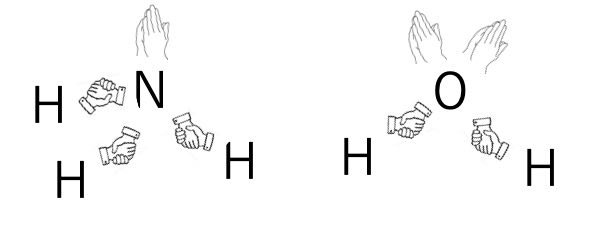
相手なしで自分で手を合わせてしまった電子2つのことを、ローン・ペア(孤立電子対)と呼びます。
エチレンの場合、H2C=の炭素は、見かけ上、手の数は3本で、3つの原子は1つの平面に乗ります。従って結合の角度は約120°になります。
ところが、アンモニアや水は、相手がいないので目に見えませんが、”結合の条件=分子軌道に2つの電子が入る”を満たしているので、そこには化学結合があります。
4つの結合があるので、ピラミッド構造(4面体角109.5°)をとります。もっとも実体の原子はないのでアンモニア(H-N-H)107.8° 水(H-O-H)104.5° と少し狭まります。
この孤立電子対を見るのも、分子軌道表示付きのデジタル分子模型ならです。
この窒素上のローン・ペアは結合としての条件は既に満たしているので、余分な電子を持たない原子とは結合を作ります。
つまり、水素が電子を一つ失った、水素イオン(プロトン)がローン・ペア上に来ると完全な四面体構造をとります。
そこで水溶液中で塩酸とアンモニアを混ぜると、窒素は4級化して、アンモニウム塩になります。これがイオン結合です。
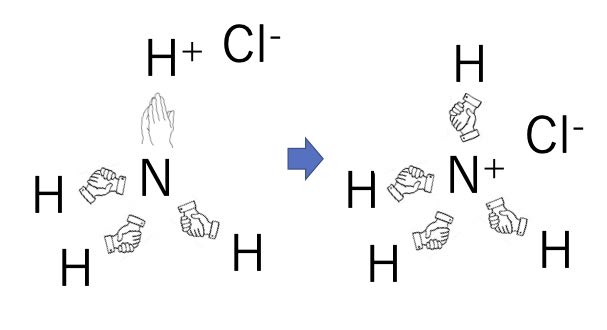
同様に、水のローンペアとプロトンも結合を作り得ます。
水中ではプロトンはH3O+ の形を取りますが、このH3O+ の拡散係数は水の拡散係数と比べ非常に大きい事が知られています。
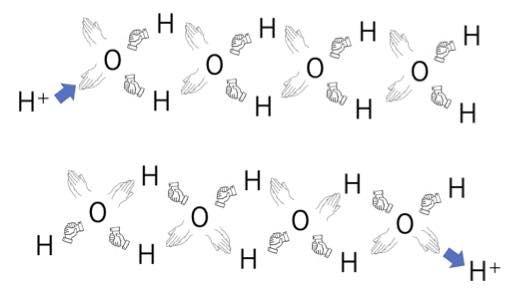
その原因に関して、200年以上も前に、Grotthussが、「プロトンは水分子間の水素結合に沿って玉突きのように移動するので拡散係数が大きい」というモデルを提案しています。
思ったより共有結合はがっしりしたものではなく、変化に富む化学結合である事がわかります。
2024.1.28 追記

同じように、イオン液体のEMI-BF4 などでは、Fイオンのホッピングが起きているのでは無いかと考えています。
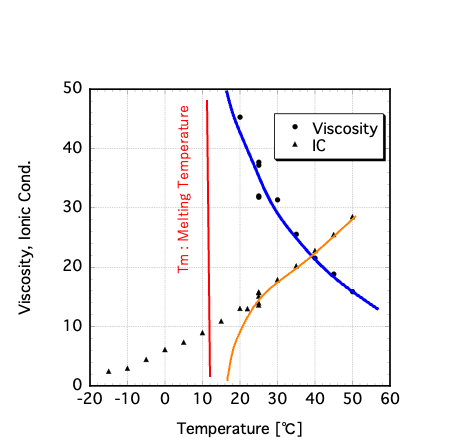
さもないと、EMI-BF4 で温度を下げて行くとTmに向けて粘度がどんどん高くなるのに、IC(Ion Coductivity)は一定に落ちていく説明がつきません。本来はオレンジの線のように落ちていくはずです。(触媒、vol. 49, No.8, 624- (2007) イオン液体の構造と物性相関 山本博志、松田弘幸、栃木勝己)
固体電解質の設計などの時には200年前のアイデアを思い出すと良いかもしれません。
パワポに貼り付けてぐりぐり回転させることができる
1.分子構造の調整。
2.分子集合体の分子模型作成。 ちょっと計算が重いので注意
3.各原子上の電荷を計算。 ちょっと計算が重いので注意
4.ある温度における分子(原子)の運動。
5.π結合とσ結合の違い。
6.作られる直前の化学結合の様子。
7.HOMO-LUMO遷移エネルギーと化学結合。
8.振動解析結果のアニメーション。
9.デジタル教科書の作成。
試しにこれらのページで電子書籍を作ってみました。
epub3のビュアーを持っているなら試してみるのも良いでしょう。
10.豊かな化学のために。
12.全フッ素化キュバンのLUMOが電子を閉じ込めた!
Webアプリ版、CNDO/2を使った教材作成について
「こういう教材を作りたいので、pirikaのアプリを使いたい」と言うご要望がありましたら、メールを頂ければ幸いです。
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください。
