2025.1.20
pirika.comで化学
>チャピエモン-3rd Pirika Origin (C-3PO)
> ハンセン溶解度パラメータ (HSP)
>HSPiP(実践ハンセン溶解度パラメータ)ソフトウエアー
> HSPiPの購入方法
> HSPiPを用いた解析例
>基礎 >応用 >ポリマー >医薬品など >環境・溶媒設計 >分析
>その他 >DIY/YMB >アバターチュートリアル >次世代に向けて
>次世代HSP2技術
> 化学全般
>Pirika Pro ツール群
ブログ
業務案内
お問い合わせ
MIユーザー用のツール群のPirika25Pro4MI
次世代HSP技術はHSPiPに搭載の機能ではありません
次世代のHSP2と新しいツール群の使い方を説明します。一般のHSPiPユーザー向けではありません。
次世代のHSP2は2017年、HSP50周年記念講演会で山本が発表した。
Hiroshi Hansen Steven Solubility Parameters for PredictionでHHSSPP=HSP2となる。2017年以降、pirika.comで開発が続けられている。クラッシクのHSPと比べ、分散項(dD項をdDvdw, dDfgに分割)水素結合項(dH項をElectron Donor/Acceptorに分割など)の取扱などが拡張された。
また多くのMI用のツールを含む。
Sphereの拡張
定量性ある「Sphereの中心」の意味について新たに解説を加えました。2023.4.24
CLIライセンスの利用:
関連ブログ:生物等価性とHSPiPのCLIライセンス
主成分分析(PCA)を用いた次元縮退
HSPをドナー、アクセプターなどに分割していくと、3次元までしか表現できないSphere法では視認性が悪くなる。そこで主成分分析(Principle Component Analysis)を用いて次元縮退することを考えた。
関連ブログ:3次元HSPから7次元HSP2へ。DXを使ってHSP2をAXしよう。
もし、HSPiPを使っていて、うまく解析できないなどの不具合があった時には、これらのことを考えてみると良いかもしれません。
次世代HSP2
ハンセン溶解度パラメータ(HSP)50周年記念の講演会が2017年に行われました。
そこで、山本は,
Hansen-Hiroshi-Steven Solubility Parameters for Prediction(HHSSPPでHSP2 )を発表しました。
これは後50年*50年、HSP2 が使われるようにとの拡張を含んでいます。
残念ながら、ここで発表した機能全てがHSPiPに搭載された訳ではありません(と言うか、まだほとんど(2022年現在)搭載されていません)。また、HSPiP本体に載せるのではなく、GUIなしで使う、CLIライセンス用プログラムへの搭載を考えています。(プロ用の機能)
ユーザーからのフィードバックがなければ、先生たちがHSP2 用の機能をHSPiPに搭載する事はありません。(コンサル契約している所には、必要に応じて別プログラムで提供することにしています。)
Dr Yamamotoによる次世代HSP2 、 Hansen-Hiroshi-Steven Solubility Parameters for Prediction(HHSSPP=HSP2 )
構成は、予稿の1-3はHSP50会議の前に読んでくることを想定しています。
そこで展開される新しいアーキテクチャを使って実際に問題を解くことをキーノート・スピーチの1-2で行っています。
予稿
Preprint-Part 1
関連ブログ:距離を極めれば、何でも溶かせる?
Dividing the dispersion term (δD) and new HSP distance 日本語版
HSPの分散項を示すδDは実は、”推算”といった意味では非常に難解でした。これまで、HSPに限らず様々な溶解度パラメータは原子団寄与法で推算する事が多かったのです。
その際に、原子団が0個(何も無い)ならδDもゼロになるはずです。ところが、定数項を0にして、原子団の寄与を求めると計算が破綻してしまうのです。
例えば、普通の直鎖炭化水素は、δP=δH=0となり、δDの値しか持ちません。ハンセン先生はそこを基底状態としてHSPの根幹を作り上げて行きました。基底状態というのは分子間力が相対的に最小になると言った感じでしょうか。
しかし、パーフルオロの炭化水素、エーテル化合物が出てくると話が困ってきます。フッ素化合物は分子間力が小さく、蒸発潜熱が低く、分子体積は大きめになります。そこで、δP=δH=0で、δDが炭化水素と比べとても小さくなります。
また、シリコーン化合物も分子間力が小さく、蒸発潜熱が低く、分子体積はかなり大きめになり、δDはパーフルオロの炭化水素、エーテル化合物に近くなります。でも両者は混じりません。
そして希ガスのSP値を検討していて1つ気づいた事があります。希ガスとパーフルオロの炭化水素、エーテル化合物の分子量、沸点曲線はほぼ同一になるという事です。
希ガスは非常に弱いVDWの分子間力しか持ちません。つまり希ガスとパーフルオロの炭化水素、エーテル化合物は分子の大きさだけに基づいた分子間力を持ちます。それを、δDVDW と定義します。これは希ガスとパーフルオロの炭化水素、エーテル化合物で検量線を引いて、分子体積から一律に求まる値です。
そして、δDの残りのエネルギーを、原子の種類や原子団によるエネルギーとしてδDfgと定義します。
δD2 = δDVDW2 + δDfg2
の関係が成立します。
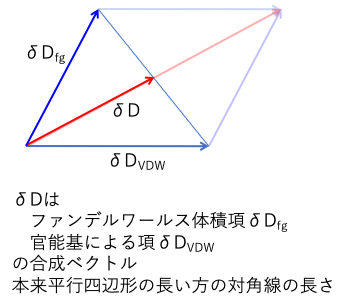
それを本来の長さの半分に定義してしまったので、距離の式でδDの差分の前には4.0という係数が必要になった。
このようにδDを分割する事のメリットは、HSP距離の計算式のδDの前に入る4.0と言うファクターがいらなくなる事です。
Distance1967 ={4.0*(δD1-δD2)2 +(δP1-δP2)2 +(δH1-δH2)2 }0.5
この4.0の説明は色々ありますが釈然としないものばかりです。
Distance2017 = {(δDvdw1-δDvdw2)2 +(δDfg1-δDfg2)2 +(δP1- δP2)2 +(δH1-δH2)2 }0.5
つまり、
4.0*(δD1-δD2)2 =(δDvdw1-δDvdw2)2 +(δDfg1-δDfg2)2
が、おおよそ、成立していると言う事です。
メリットはデメリットで、HSPが4次元ベクトルになってしまい、グラフで表示するのが難しくなりました。ただ、分子の大きさだけに基づく、δDvdwを無視して、δDfgとδP、δHだけで評価しても結果は大きくは変わりません。
特に、Materials Informaticsなどで結果を使う分には、次元の高さは問題ないので、CLIライセンスバージョンに組み込む事が考えられています。
例えば、次のケイ素化合物とフッ素エーテルは、以前のHSPで見ると非常に似通っています。
Distance1967 = 2.0
ですので容易にお互いが混じると考えてしまいます。
しかし、
Distance2017 = 8.5
と大きく異なります。
これらの系で実際に試した事はありませんが、フッ素オイルとシリコーンオイルは溶け合わないのは不思議なこととして知られています。そうした問題を解決するには、このHSP2 技術は有効でしょう。
| Smiles | dD | dDvdw | dDfg | dP | dH | |
| Dimethoxydimethylsilane | CO[Si](C)(C)OC | 12.82 | 9.88 | 8.16 | 3.19 | 4.03 |
| 1,1,2,2,2-Pentafluoroethyl 2,2,3,3,3-pentafluoropropyl ether | FC(C(COC(C(F)(F)F)(F)F)(F)F)(F)F | 12 | 12 | 0.02 | 3.59 | 2.88 |
Preprint-Part2
δNet parameter which hid for 50 years 日本語版
元々、HildebrandのSP値は正則溶液に対するものでした。正則溶液の定義としては、溶質と溶媒の間の凝集力がロンドンの分散力のみの場合をいいます。それでは何かを溶かす前の溶媒自体の”正則性”を考えてみます。
RT(ガス定数*温度)を無視すれば、SP値は次のように書く事ができます。
SP = sqrt( Hv/Volume)
つまり、分子体積(Volume)が倍になっても、蒸発潜熱(Hv)が倍になるのであれば、SP値は同じになります。
多くの場合、溶媒の系列が同じであれば、傾きや切片によって多少変化しますが、この関係はおおよそ満足します。
分子体積と沸点の間には、次図のように、溶媒の系列が同じであれば、ほぼ同一の曲線上に乗る事が知られています。 分子体積のルートを取るとこれは直線になります。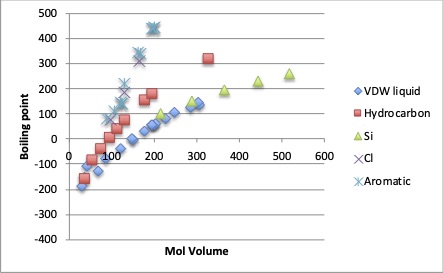
また、沸点と蒸発船熱の間には、Troutonの通則と言うのがあり、沸点での蒸発潜熱を沸点で割った値は、85 J/(mol·K)となる事が知られています。例外となるのは水素結合性の水、低分子量のアルコール、カルボン酸化合物です。同族体であれば分子の大きさが決まれば沸点が決まり、沸点が決まれば比例して蒸発潜熱が決まることになります。
そこで、Troutonの通則、沸点での蒸発潜熱を沸点で割った値が、85 J/(mol·K)となる溶媒を正則溶媒と呼ぶこともあります。つまり、エステル化合物であろうが、エーテル化合物であろうが、沸点が同じなら、蒸発潜熱は同じになります。
水素結合性のアルコールは、水素結合のネットワークを作ります。
そこで、沸点ではそのネットワークを切るのに余分なエネルギーが必要になります。
HSP2 では、Troutonの通則を25℃へ拡張し、正則溶媒部分をδregとし、残りをδNetと定義します。計算に必要な、δtotと分子体積、沸点は既知ですので、簡単に値が求まります。
基本的に、
δNetの大きな溶媒は、δNetの小さな溶媒とは混合しない。
δNetを大きくする官能基を持ったポリマーは、ガスバリアー性が高い。
など正則性からのズレだけが関与する物性も多い事が明らかになってきています。
Preprint-Part3
Donor/Acceptor interaction 日本語版
実は、HSPは既に水素結合項をドナー/アクセプターに分割しています。まず言葉の定義ですが、HSPiPに搭載されているのは酸/塩基でドナー/アクセプターではありません。
Abrahamの酸塩基を推算し、それを水素結合項に割り振っています。
また、取り扱い上も
Rule 1: δH2 = δHacid2 + δHbase2
Rule 2: δHacid:δHbase = Abraham Acid:Base
Rule3: AbrahamAcidが0の場合δHacid=0、δHbase=δH
水素結合項にドナー/アクセプター性を割り振ってしまいます。
すると、例えば、δHが非常に小さな化合物、例えば、四塩化炭素(δH=0.6)のδHAcid、δHBaseはとても小さくなり、溶解性にほとんど寄与しなくなってしまいます。
Gutmann ドナー数(DN), アクセプター数(AN)を推算する式を構築し、その値をAbrahamの時と同じ方法で、δHDonor、δHAcceptorに分割したり、Beerbowerの方法に従って分割したりしましたが、HSPの距離の式までは構築できていません。
HSP2 では、現在のところ、δHDonor、δHAcceptor、DN, ANを含めMaterials Informatics用の識別子として用いるのが現実的な利用法になっています。
キーノート・スピーチ
以上の、HSP2 の3つの拡張に関する予稿を読んだと言う前提で、次の2つのキーノート・スピーチを行いました。
Yamamoto Keynote Speech1
(英語版)
今までのHSPの決定方法と、その問題点、改良方法を概説しました。特に、これまではδDに関しては大きく問題にされる事はありませんでした。しかし、δDには分子の大きさだけで決まる部分と、原子種(原子団)による効果が合わさったものである事がわかりました。δP、δHに関しても、様々な方法を組み合わせることによって、データベース中のオフィシャル値の検証も行いました。また、温度の影響を新しく見積もる方法を開発しました。
Yamamoto Keynote Speech2
(英語版)
正則溶液理論から導き出される結論として、分子の溶解度パラメータを正則溶媒としてのδregと、正則溶媒から外れるδNetに分割する方法を開発しました。また、Lewis Electron Donor(ED)と Electron Acceptor(EA)を予測する式を構築しました。そうした様々な分割手段を組み合わせると、クラッシックなHSPでは、ほぼ同じHSP値になるエステル、アミン、カルボン酸が全く違う見え方になってくる事がわかりました。
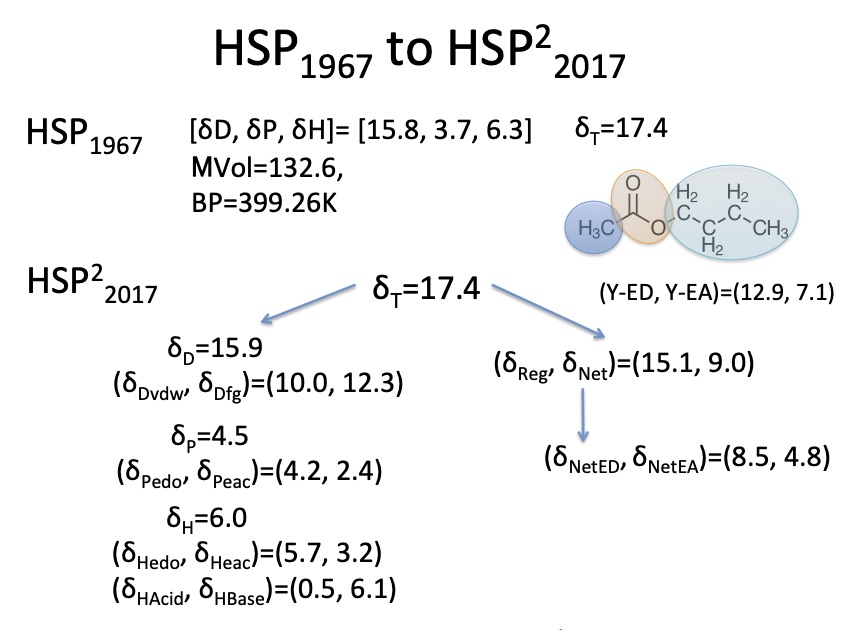
キーノートスピーチの1,2に関しては、HSP勉強会(2017年9月)で日本語で発表しています。
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください。
