蒸発潜熱と沸点の間には、Troutonの通則というものがあり、非極性の化合物であれば
Lb/Tb=21 cal/g-mol
という関係があることが知られている。この場合の蒸発潜熱は沸点における蒸発潜熱であるが、容易に25度へ拡張できる。
試しに、化合物の沸点と25度での蒸発潜熱をプロットすると下のようになる。
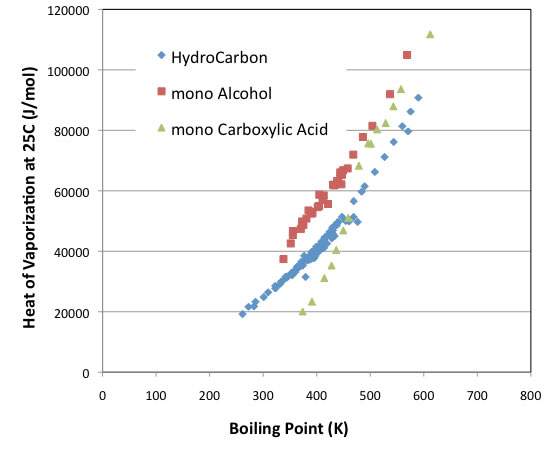
化合物の種類によって切片は異なるが、だいたい平行な曲線になる。
例外はカルボン酸化合物で、沸点が480Kを超えるようなカルボン酸化合物ではアルコールに近い挙動を示すが、それ以下では官能基を持たない炭化水素化合物の蒸発潜熱より、さらに小さくなる。
この現象は、化学工学で蒸留を扱う分野ではよく知られた現象である。
試しに、酢酸のダイマーの3次元座標を作って、電荷平衡法(QEQ)を使って電荷を計算してみる。
何故これまでやらなかったのか分からないが、ダイポールモーメントの値は内部では計算してあったのに、表示させていなかった。このダイマーのダイポールモーメントは0.409と、とても小さくなる。
Drag=回転, Drag+Shift キー=拡大、縮小, Drag+コマンドキーかAltキー=移動。
モノマーでは大きなダイポールモーメントになる。
実際に気相中のIRをとるとわかるらしいが、気相中でもダイマーのまま飛び回っているらしい。
本来、水素結合は2次元、3次元のネットワークが作られると、蒸発潜熱は大きくなる。炭化水素と比べ、アルコール化合物の曲線は上にくる。
でも、2分子間水素結合のように閉じた水素結合を作ると、蒸発潜熱は小さくなる。
蒸発潜熱はハンセンの溶解度パラメータを決めるのに使う大事な指標だ。カルボン酸の扱いはいつも困る。
