2025.06.08
pirika.comで化学
>チャピエモン-3rd Pirika Origin (C-3PO)
> ハンセン溶解度パラメータ (HSP)
>HSPiP(実践ハンセン溶解度パラメータ)ソフトウエアー
> HSPiPの購入方法
> HSPiPを用いた解析例
>基礎 >応用 >ポリマー >医薬品など >環境・溶媒設計 >分析
>その他 >DIY/YMB >アバターチュートリアル >次世代に向けて
>次世代HSP2技術
> 化学全般
>Pirika Pro ツール群
ブログ
業務案内
お問い合わせ
注意:HSPiPの機能ではありません
堀場とAshizawa共催の粒子分散評価セミナー2025に行ってきた。
Ashizawaのボール・ミルでの分散の話は面白かった。ボールのサイズを小さくすることによって、とても安定性の高い微粒子分散体が作れるという。
湿式分散の話ではあったが溶媒効果については特に触れていなかった。
(化粧品用の微粒子分散体として、化粧品に使われるオイル成分との相互作用をマジェリカ・ジャパン様がパルス・NMRを使って解析していた。)
今回の種論文
顔料分散の溶解性パ ラメー ター による若干の評価 分散性パラメーターの決定
大日本塗料(株) 色材, 47 (1974) 47_411
とても古い論文だ。
実は、この論文以前に解析した結果をすでに公開している。
酸性顔料、塩基性顔料の分散
次世代HSP2の使い方を詳しく説明しているので参考にしてほしい。
分散装置
チューブ・ミルという装置をつかって、振盪した後、すぐにゲージで分散粒度を測定する。
試験結果
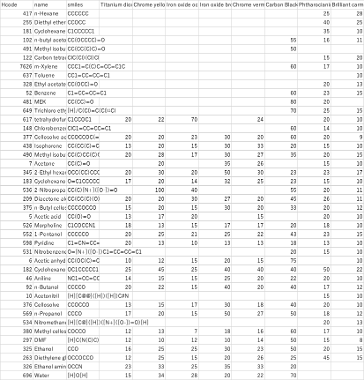
空欄のところは2相分離してしまった為粒度測定できなかったもの。粒度は小さいものほど良溶媒となる。
HSPiPを使った解析
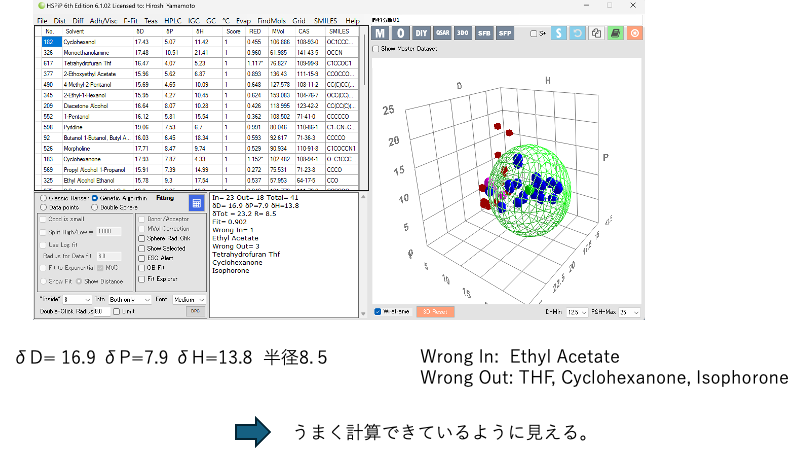
いくつかのWrong In/Outはあるが溶解球の内側と外側に分離できる。
HSPの原理では、ここで求まったδD= 16.9 δP=7.9 δH=13.8 がTiO2のHSPで、この値と溶媒のHSPが一致(HSP距離がゼロ)した時、もっとも良溶媒で、粒度は最も細かくなると考える。
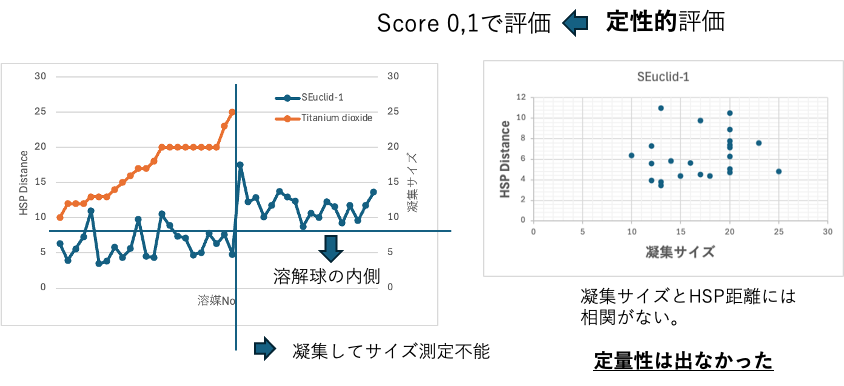
しかし、これは定性的な解析で凝集サイズとHSP距離には相関がなかった。
HSPを使った定量的解析
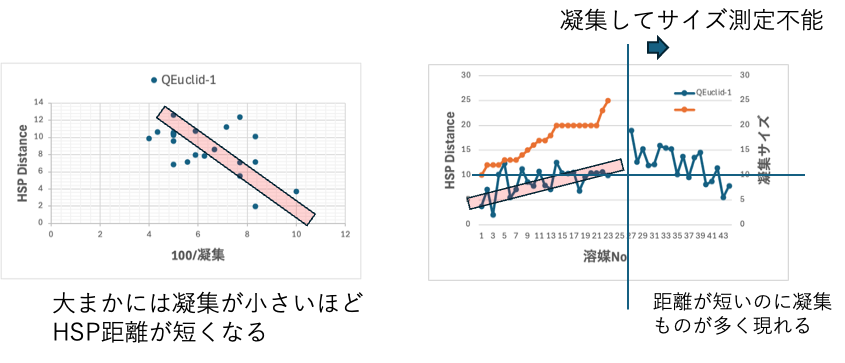
[dD, dP, dH]=[16.3, 14.7, 11.9] と求まり、おおまかには粒度が小さなものほどHSP距離が短くなる。しかし凝集してサイズ測定不能の溶媒であってもHSP距離の短いものがある。より良い溶媒を探索するのにHSP距離は使えない。
凝集はHSP理論では説明できない?
論文中の説明:
カーボン以外の顔料が親水性。凝集の要因として顔料の酸性一塩基性度の影響も考えられるが, 主には水分が関与していると考えられる。
無極性溶媒中に親水性粒子が分散している系では,溶媒中の少量の水分が優先的に粒子表面に移向し水の吸着層をつくり、溶媒との親和性が小さいために吸着層どうしがからみ合い凝集すると考えられる。
種論文では、粒度分布をHSPで議論している割に、凝集の要因を水分だとしている。
セミナーの最中にも水の吸着による分散性の変化に関する質問も飛んでいた。
分散ではなく粉砕(特に乾式での)の場合は、粒子が割れた表面には、すぐに水が吸着すると言われている。
ハンセン空間で見てみる
マウスでドラッグすると回転する(Shift-Drag:拡大縮小、Option-Drag:移動)
球をクリックすると溶媒名が表示される。凝集してしまった溶媒は赤い球で示してある。後の溶媒は青色に近づくに連れ青っぽい色になるように調整してある。
緑色の大きな球がハンセンの溶解球となり、溶解球の中心がTiO2のHSPとなる。
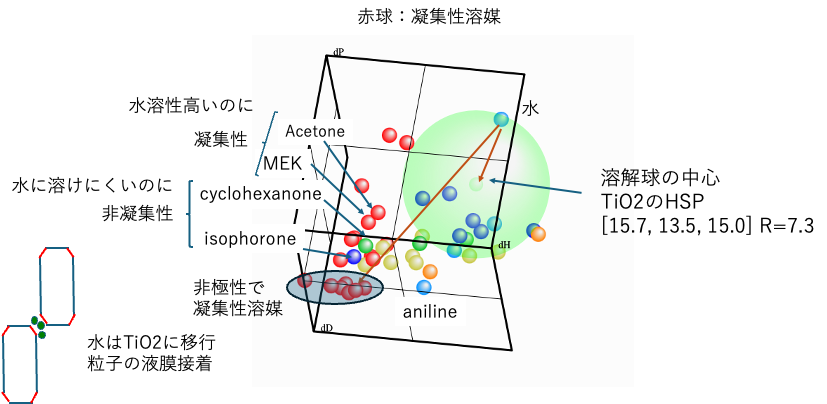
水はハンセン空間中でdH, dPが大きいところに配置されている。
いわゆる非極性溶媒はdP, dHが小さなところにかたまって存在している。これは水の位置からとても遠いので、水はTiO2に移行して凝集体を作るという説明はそれなりにもっともである。しかし、isophoroneやcyclohexanoneも水からは遠く離れていて水には溶けにくいのに非凝集性である。Acetoneやアセトニトリルは水溶性が高いのに凝集性になる。
水のTiO2への吸着だけで凝集、非凝集を説明することはできない。
次世代HSP2を使った解析
詳しくは「HSP距離の33式詳説」を読んで頂きたい。クラッシクな3次元HSPに対して、水素結合項を分割するのが味噌だ。「AIに星座は見えるだろうか?」でも分割が有効であると示せた。
最初のグラフではクラッシクな3次元HSPが表示される。ハンセンの溶解球はマゼンタで表されている。溶解球の半径はとりあえず固定にしてある。
1 : sqrt(4.0*(16.7-dD2)2+(7.4-dP2)2+(12.7-dH2)2)
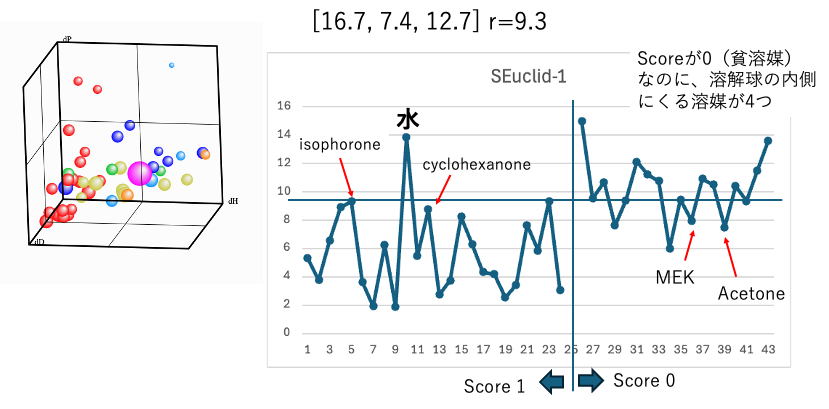
33式の一番目のクラッシクな3次元HSPは[dD, dP, dH]=[16.7, 7.4, 12.7] r=9.3と求まる。マゼンタの球の半径を9.3まで広げてしまうと、凝集性の貧溶媒アセトン、MEK, エステルの4溶媒が溶解球の中に入ってきてしまう。アセトンやMEKを球の外側に置くように半径を小さくすると、逆にisophoroneやシクロヘキサノンなどの非凝集性の良溶媒が球の外に出てしまう。分離性の悪い溶解球しか作れない。
4 : sqrt(4.0*(19.5-dD2)2+(8.7-dP2)2+ (12.5-dHacL2)2+(21.4-dHbaL2)2)
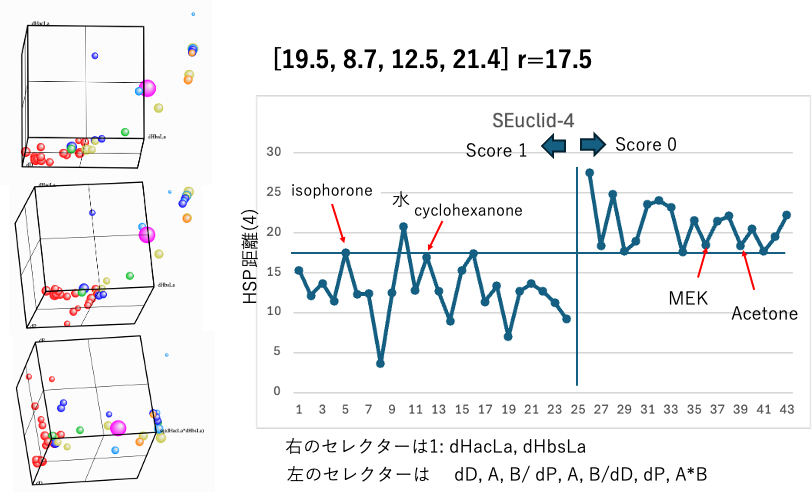
Scheme(4)では、水素結合をdHacLa, dHbsLaの2つに分割する。
右のセレクターはdHacLa, dHbsLaにして、軸のアサインを変えてハンセン空間を見てみよう。
分子を構成する原子団ごとにdHacとdHbsを割り振る。Laというのは原子団の中で一番大きなdHac, dHbsだけを考える。そうすると例えばモノアルコールとジオールでdHacLa, dHbsLaがおなじになってしまうので、少し傾斜が導入してある。Wrong In/Outとなるのは水だけなのでモデルとしては良さそうに見える。ただし、3次元座標にプロットしてみると、ほとんどの化合物はdHacLaを持たない。ブレンステッドの酸塩基の定義では、電気陰性度の高い酸素や窒素に付いたプロトンが(両性としての)酸性を持つ。それ以外の化合物は全て塩基性となる。誤認識は少ないが3次元空間で見ると良いモデルとは思えない。
8 : sqrt(4.0*(17.5-dD2)2+(6.9-dP2)2+ (3.7-yEDL2)2+(4.4-yEAL2)2)
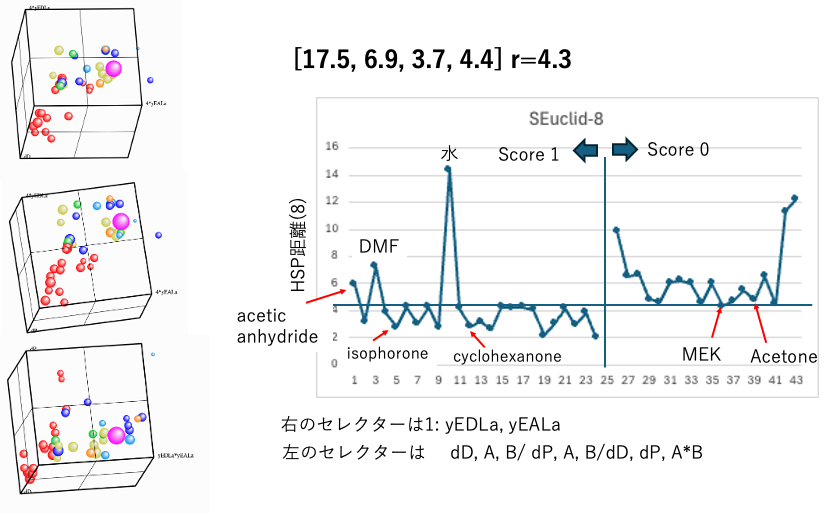
Scheme(8)では、水素結合をyEDLa, yEALa (Electron Donor/Acceptor)の2つに分割する。
右のセレクターはyEDLa, yEALaにして、軸のアサインを変えてハンセン空間を見てみよう。無水酢酸とDMF、水がWrong outになってしまうが、得られた3次元プロットはとてもリーズナブルと言える。
11:sqrt(4.0*(20.8-dD2)2+(7.0-dP2)2+(16.4-ABacid2)2+(20.2-ABbase2)2)
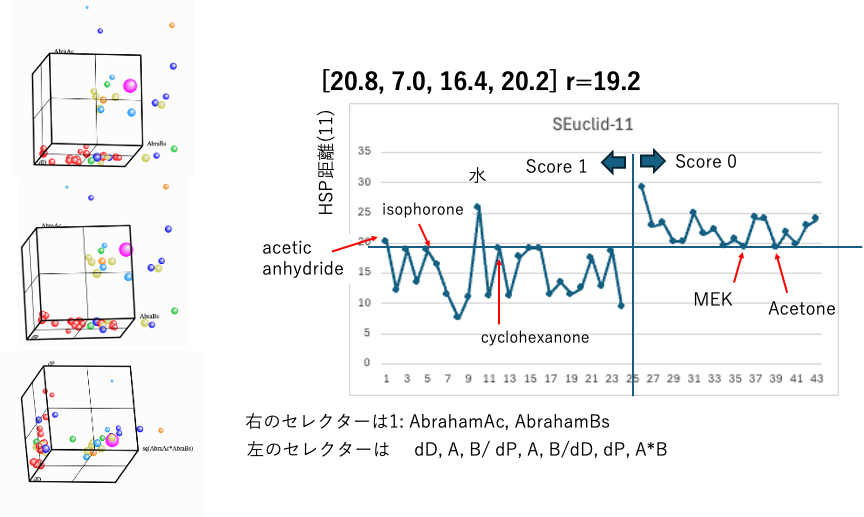
Scheme(4)と同じで、AbrahamのAcid/Baseはブレンステッド酸塩基であるので(4)式とほぼ同じような傾向となる。3次元プロットからは良いモデルとは言えない。
分子中で一番大きい官能基のみを考慮
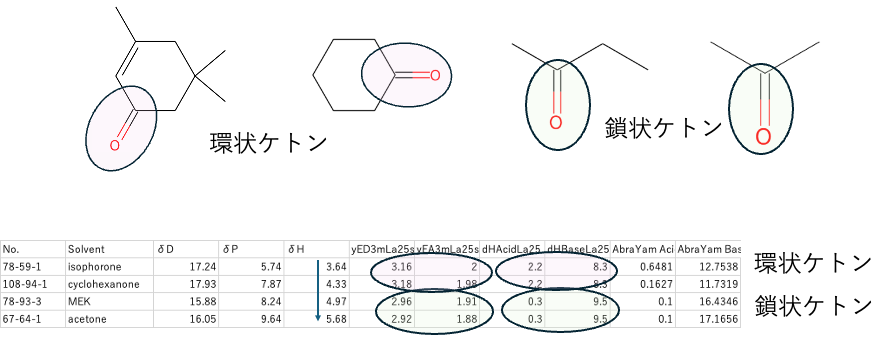
補足:
例えばケトン類のdHは分子が小さくなるに連れ大きくなる。dHacLaとdHbsLaは環状ケトンであれば同じ値になる。yEDLaとyEALaは多官能補正が入るので少し変わるが基本ケトンの種類で決まる。
チューブ・ミルでの分散・凝集のメジャープレイヤーはED/EA
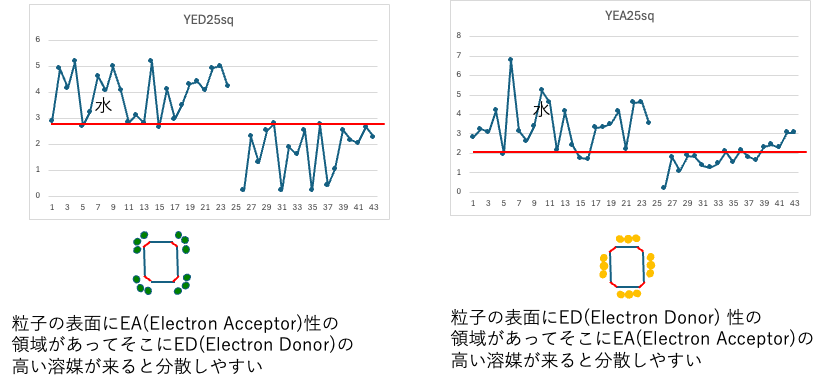
式(8)のモデルからメジャー・プレイヤーがED/EAであることがわかった。検証のためプロットしてみると、EDやEAが小さいものは凝集しやすいという明確な傾向が得られた。
関西ペイントの論文
Atsunao Hiwara and Toshihide Fujitani, Research of Paint No.132 Apr. 1999ではTiO2の酢酸吸着量とアンモニア吸着量が測定されている。

この事はHSP2での解析結果と矛盾しない。
粘度が効いているという説もある
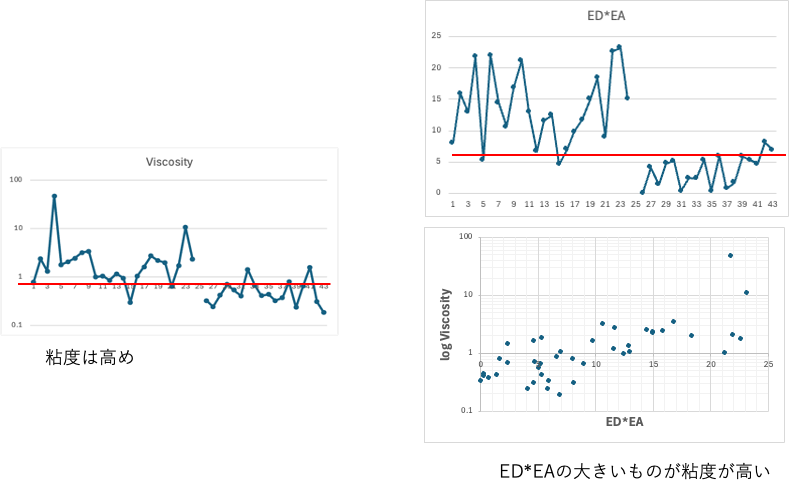
振盪のときのせん断力なども議論されるが、データ駆動的には粘度が低いものは凝集しやすい。粘度が高い化合物は、分子量が大きいと言える。ただし分子中に大きなEDとEAを持つ(ED*EAが大きい)と分子間のED/EA相互作用で粘度が高くなる。
定量的な粒度予測
31: (11.2-dDvdw2)2+ (11.5-dDfg2)2+(12.6-dP2)2+5.17* (2.8-yED2)*(2.7-yEA2)
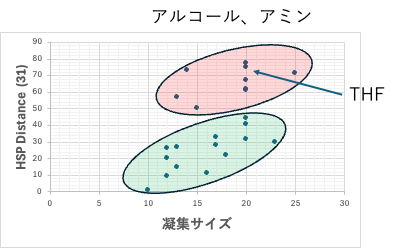
アルコール、アミン, THFとそれ以外で検量線は異なる。アルコール、アミン以外では無水酢酸のHSP距離が0のとき凝集サイズ10で最小になる。
(31)式はBeerbowerタイプの距離の式になる。ユークリッドタイプの式では差分の2乗だが、EDの差分とEAの差分を掛けたものになる。
この場合、溶媒のyED>2.8 yEA<2.7の時と、yED<2.8 yEA>2.7の時に
5.17* (2.8-yED2)*(2.7-yEA2)
は負になる。dDvdw=11.2, dDfg=11.5, dP=12.6になるべく近く
yED>2.8 yEA<2.7
yED<2.8 yEA>2.7
の時HSP距離は一番短くなる。そのようなアルコールかアミンを探すことになる。
通常の溶媒探索よりは複雑になる。
グリーン・ソルベントから探索
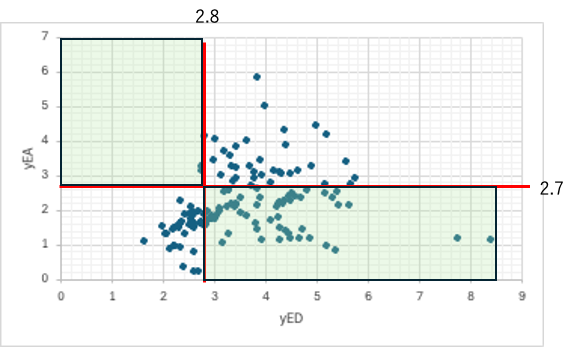
化粧品用に使われるグリーンソルベントから距離をマイナスにするED/EAの領域を探してみた。多くの該当溶媒が存在する。(31)式からHSP距離が低く使いやすいものから試していくのが合理的だ。
ミルの溶媒効果をHSPでミル
ボールミルの溶媒効果については想像でしか無い。そもそも比重差や粘度の方が影響が大きい?
でも次世代HSP2はいろいろ見えないものを見せてくれる。
そんな事を思えるようなセミナーを企画してくださった堀場さんに感謝!
Copyright pirika.com since 1999-
Mail: yamahiroXpirika.com (Xを@に置き換えてください)
メールの件名は[pirika]で始めてください。
